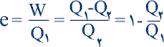|
مهـــــــندســی شــــیـمــی به نام او که سرخ رویی ما به مدد لعل لب اوست /// درباره وبلاگ  بنام خدا سلامی چو بوی خوش هیدروکربنهای آروماتیک برشما که قلبهایتان همچون فلزات قلیایی الکترون های وجودتان را سخاوتمندانه به ما بخشیدند و مستحکم ترین پیوندقلبی را ایجاد کردند ، ما از با شما بودن چیزی فراتر از استوکیومتری زندگی ومولاریته شادیها آموختیم امیدواریم محلول زندگی تان همواره شفاف و معادلات زندگی تان پیوسته موازنه شده و پیوند خانوادگی تان یونی ترین پیوندها و بختتان همواره به سفیدی سدیم کلرید و محلول زندگی تان از عشق و محبت فراسیرشده باشد با بیشترین درصد خلوص دوستتان داریم وبا بالاترین غلظت به شما خوشامد میگوئیم کاربر گرامی شما میتوانید مطالبی که دوست دارید در سایت ما منتشر شود را برای ما ارسال نمایید.به این ترتیب مطلب با نام شما پس از تایید در سایت ما به نمایش گذاشته خواهد شد آخرين مطالب
نويسنده لينک هاي مفيد سه شنبه 27 دی 1390برچسب:, :: 23:23 :: نويسنده : پوریا جعفری
1. جزوه انتقال حرارت شریف حجم فایل 63 مگابایت ........... http://www.4shared.com/file/npM2qmu9/jozvehaie_darsi.html
رای دریافت جزوه مکانیک سیالات از لینک زیر استفاده کنید
برچسبها: سه شنبه 27 دی 1390برچسب:, :: 23:22 :: نويسنده : پوریا جعفری
برچسبها: سه شنبه 27 دی 1390برچسب:, :: 23:21 :: نويسنده : پوریا جعفری
اوّلین درس در زمینه مهندسی شیمی نخستین بار توسط پروفسور «نورتون» در سال ۱۸۸۱ در دانشگاه MIT و در دانشکده مکانیک تدریس شد. نورتون شیمی صنعتی تدریس میکرد. در آن زمان صنایع شیمیایی رو به توسعه گذاشته بودند و لازم بود ساخت و بهره برداری از فرآیندهای شیمیایی توسّط افراد متخصّص صورت گیرد. در آن زمان طرّاحی و نظارت بر ساخت فرآیندهای شیمیایی و صنایع شیمیایی به دو شکل صورت میگرفت: ۱) به وسیله شیمی دانهایی که از تئوریهای شیمیایی و علوم آزمایشگاهی آگاهی داشته، ولی اطّلاعات فنّی و تجارب کافی از طراحی صنعتی نداشتند. ۲) به وسیله مهندسان مکانیکی که تجربه طرّاحی صنعتی داشتند، ولی اطّلاعات کافی از فرآیندهای شیمیایی نداشتند. این موضوع باعث شد که تا مدّتی برای طرّاحی واحدهای شیمیایی از شیمیدانان و مهندسان مکانیک به صورت مشترک استفاده شود. امّا برای هماهنگ کردن کار این دو گروه، به افرادی نیاز بود که هم از فرآیندهای شیمیایی و هم از طرّاحی صنعتی مطّلع باشند و هم تجربههای آزمایشگاهی لازم را داشته باشند. از این رو رشتهای جدید در دانشگاهها با نام «شیمی صنعتی» یا «صنایع شیمیایی» به وجود آمد. با تئسعه تدریجی صنایع شیکیایی، نیاز به چنین متخصّصانی که هم در زمینه طرّاحی صنعتی و هم در زمینه فرآیندهای شیمیایی تخصص داشتند، بیشتر احساس شد. به این ترتیب، دورههایی با نام «مهندسی شیمی مدرن» در دانشگاهها پایه گذاری شدند. توسعه صنایع شیمیایی باعث شد که دانشگاهها اقدام به تأسیس دانشکده مهندسی شیمی به صورت مجزّا کرده و آن را جدا از رشتههای شیمی و مکانیک تدریس کنند. [۳]
مهندسی شیمی در ایران نخستین بار در «مدرسه صنعتی ایران و آلمان» تدریس شد. این مرکز آموزشی که پس از جنگ جهانی اولبه عنوان غرامت جنگی به ایران واگذار شده بود، در هر کدام از رشتههای مهندسی شیمی، برق و ماشین حدود بیست دانشجو میپذیرفت. دانش آموختگان مدرسه صنعتی ایران پس از یک دوره تحصیلی دو ساله «مهندس شیمی» نامیده میشدند. امّا در برنامه درسی آنها دروسی چون «شیمی تجزیه» و آزمایشگاه وجود داشت که دروس مربوط به رشته شیمی است. در سال ۱۳۱۳ «دانشگاه تهران» تأسیس شد و رشته مهندسی شیمی یکی از رشتههای ارائه شده در دانشکده فنّی بود. در این میان، رقابتهای ناسالم میان دانش آموختگان دانشکده فنّی و مدرسه صنعتی موجب شد تا مدرسه عالی صنعتی منحل شود. در سال ۱۳۳۶ «دانشگاه صنعتی امیرکبیر» (پلی تکنیک تهران) تأسیس شد و در رشته مهندسی شیمی و برای یک دوره چهار ساله به پذیرش دانشجو اقدام کرد. امّا برنامه درسی آن زمان دانشگاه تهران و پلی تکنیک هنوز با برنامه واقعی مهندسی شیمی تفاوت بسیار داشت. درسهایی مانند «انتقال حرارت»، «انتقال جرم» و «طراحی رآکتور» در سرفصل دروس گنجانده نشده بودند و از تنها درسهای ویژه مهندسی شیمی «تقطیر»، «جذب» و «ترمودینامیک» را میتوان نام برد. پس ازاین دو دانشگاه، «دانشگاه شیراز» و پس از آن در سال ۱۳۴۵ «دانشگاه صنعتی شریف» (صنعتی آریا مهر سابق)این رشته را راه اندازی کردند[۴] که برنامه درسی آنها تفاوت چندانی با برنامه درسی که امروز در رشته مهندسی شیمی ارائه میشود نداشت. در سالهای بعد، دوره کارشناسی ارشد و در برخی دانشگاهها دوره دکتری مهندسی شیمی نیز راه اندازی شد برچسبها: سه شنبه 27 دی 1390برچسب:, :: 23:19 :: نويسنده : پوریا جعفری
مهندسی شیمی علم کاربرد ریاضیات، شیمی، فیزیک و اقتصاد در فرآیند تبدیل مواد خام به مواد باارزشتر یا سودمندتر است. مهندسی شیمی را میتوان بطور کلی علم استفاده از موازنه جرم، موازنه انرژی و موازنه اندازه حرکت برای طراحی و کنترل واحدهای فرآیندی شیمیایی از قبیل واحدهای یک پالایشگاه پتروشیمی، صنایع چوب و کاغذ و غیره در نظر گرفت. مهندسی شیمی عمدتاً در طراحی و نگهداری فرآیندهای شیمیایی برای تولید انبوه به کار میرود. به این بخش از مهندسی شیمی، مهندسی فرآیند گفته میشود. فرآیندهای مجزایی که توسط یک مهندس شیمی به کار گرفته میشوند (مانند تقطیر، استخراج و...)، عملیات واحد نام داشته و شامل واکنش شیمیایی، عملیات انتقال جرم، انتقال حرارت و انتقال اندازه حرکت هستند. این فرآیندها برای سنتز شیمیایی یاجداسازی شیمیایی با هم ترکیب میشوند. سه قانون فیزیکی اساسی در مهندسی شیمی، اصل بقای جرم، اصل بقای انرژی و اصل بقای اندازه حرکت هستند. انتقال ماده و انرژی در یک فرآیند شیمیایی با استفاده از موازنه جرم و انرژی برای کل واحد، عملیات واحد یا بخشی از آن ارزیابی میشود. مهندسین شیمی اصول ترمودینامیک، سینتیک واکنش و پدیدههای انتقال را به کار میگیرند. مهندسی شیمی نوین، گسترهای فراتر از مهندسی فرآیند را در بر میگیرد. هدف اصلی مهندسی شیمی استفاده از دانش شیمی در خلق مواد و محصولات بهتر برای دنیای امروز است. امروزه مهندسین شیمی علاوه بر فرآیندهای تولید مواد اولیه پایه، بلکه در تو سعه و تولید محصولات باارزش و متنوع شرکت دارند. این محصولات شامل مواد ویژه و کارآمد برای صنایعی همچون هوافضا،خودروسازی، پزشکی، صنایع الکترونیک، کاربردهای محیط زیست و صنایع نظامی است. به عنوان مثالهایی از این محصولات میتوان به الیاف، منسوجات و چسبهای بسیار قوی، مواد زیستسازگار و داروهای جدید اشاره کرد. امروزه مهندسی شیمی ارتباطی تنگاتنگ با علوم زیستشناسی، مهندسی پزشکی و اغلب شاخههای مهندسی دارد برچسبها: دو شنبه 26 دی 1390برچسب:, :: 11:57 :: نويسنده : پوریا جعفری
برچسبها: دو شنبه 26 دی 1390برچسب:, :: 11:57 :: نويسنده : پوریا جعفری
حل معادلات با ورود به سایت زیر میتوانید نحوه حل معادلات از درجات مختلف را دانلود نمایید. لازم به ذکر است که کلیه مقالات در قالب PDF میباشد. برای ورود به سایت به ادامه مطلب بروید. برای ورود به سایت اینجا کلیک نمایید. برچسبها: دو شنبه 26 دی 1390برچسب:, :: 11:57 :: نويسنده : پوریا جعفری
دانلود فرمولهای مشتق گیری ( 56k ) دانلود فرمولهای مثلثاتی ( 64k ) دانلود فرمولهای حد ( 47k )
برچسبها: دو شنبه 26 دی 1390برچسب:, :: 11:57 :: نويسنده : پوریا جعفری
دانلود روشهای حل معادله درجه سوم و چهارم در قالب برنامه ورد با حجم ۱۹۲ کیلو برچسبها: دو شنبه 26 دی 1390برچسب:, :: 11:57 :: نويسنده : پوریا جعفری
در سال 1873 واندروالس، شیمیدان هلندی، نشان داد كه افزودن دو پارامتر به معادله گاز ایدهآل، قسمت اعظم انحراف گازهای حقیقی از رفتار ایدهآل را میتواند توجیه كند. او عدم موفقیت رابطهی PV= nRT را در بیان رفتار حقیقی به نادیده گرفتن دو عامل زیر نسبت داد: 1) حجم اشغال شده توسط مولكولهای گاز 2) نیروهای جاذبه بین مولكولها میدانید كه مدل جنبشی- مولكولی گازها كه در نهایت منجر به قانون گازهای ایدهآل شد شامل فرضهای زیر است: در واقع واندروالس بیان كرد كه فرضهای 1 و 4 كه یكی از حجم مولكولها و دیگری از نیروهای بین آنها صرف نظر میكند صحیح نمیباشند. اكنون اصلاحاتی را كه با تشخیص این دو عامل به عمل میآید، یك به یك بررسی میكنیم: وقتی n مول گاز در ظرفی به حجم V گذاشته میشود، حجمی كه در آن مولكولها آزادانه حركت میكنند، فقط در صورتی برابر با V است كه از حجم اشغال شده توسط خود مولكولها صرف نظر شود. (به عنوان مثال شما و دو تن از دوستانتان در یك اتاق 12 متری مشغول بازی هستید. در صورتی میتوان گفت شما 12 متر مربع برای بازی در دسترس دارید كه از سطحی كه خودتان اشغال كردهاید، صرف نظر شود. حال اگر هر یك از شما 400 سانتیمتر مربع اشغال كنید، در این صورت سطحی كه برای بازی در دسترس دارید، برابر است با: منظور كردن حجم خود مولكولها به این معنی است كه حجم معینی كه به نام حجم كنار گذاشته شدهرموسوم است، در اختیار مولكولها نخواهد بود كه در آن حركت كنند. اگر حجم كنار گذاشته شده توسط هر مول، b باشد، در این صورت به جای نوشتن PV= nRT ، معادلهی مناسبتر زیر را خواهیم داشت: P(V – nb) = nRT حجم كنار گذاشته شده توسط هر مول یا b، معمولا" به عنوان ثابتی در نظر گرفته میشود كه از مشخصات هر گاز است و باید از روی دادههای تجربی محاسبه شوند. به عنوان مثال، حجم كنار گذاشته شده در مورد مولكولهای كروی به قطر d ، بیش از حجم خود مولكول است . میدانید حجم خود مولكولی با قطر d و شعاع r برابر 4/3pr**3 (p به معنای عدد پی و برابر 14/3 میباشد و ** به معنای به توان رسیدن است.) است، در حالی كه حجم كنار گذاشته شده به ازای هر مولكول، حجمی كه عملا" مولكولهای دیگر نمیتوانند وارد آن محدوده شوند، برابر 4 برابر حجم مولكول است: 4{4/3 p r**3} = حجم كنار گذاشته شده به ازای هر مولكول دومین جملهی اصلاحی در معادلهی واندروالس، مربوط به نیروهای جاذبهی بین مولكولها است. وجود این نیروها با توجه به تمایل گازها به متراكم شدن در دماهای پایین، تا آن اندازه كه بتوانند انرژی جنبشی را خنثی كنند، ثابت میشوند. در واقع ابتدا كه مولكولها به یكدیگر نزدیك میشوند، همدیگر را جذب مینمایند، ولی اگر با هم برخورد كنند، یكدیگر را دفع میكنند. به وسیلهی جاذبهای كه یك مولكول روی مولكولهای مجاور اعمال میكند، آنها را به طرف خود میكشاند. در واقع اثر این جاذبه به همراه فشاری كه بر روی گاز وارد میشود، سبب میشود تا مولكولهای یك گاز با هم بمانند. تحلیل كامل نتیجهی این عمل مشكل است، ولی به طور كیفی اثرش این است كه استقلال مولكولهای گاز در اثر این نیروها كاهش مییابد. از این رو، فشاری كه گاز اعمال میكند، درست مثل اینكه تعداد مولكولهای گاز كاهش یافته باشد، كم میشود. ( به عنوان مثال دو دانشآموزان در كلاس در هنگام حضور معلم، كه به منزله نیروهای جاذبه است، خیلی بیشتر در كنار هم میمانند و به در و دیوار ضربه میزنند، درواقع فشار جو كلاس و تعداد برخوردهای دانشآموزان در هنگام حضور معلم بسیار كاهش مییابد.) اثر یك مولكول، از نظر كمك در نگاه داشتن مولكولهای گاز با هم، از طریق این نیروهای جاذبه، با تعداد مولكولهای مجاور كه میتواند روی آنها اثر كند، متناسب است. اگر n مول گاز در حجم V وجود داشته باشد، آن تعداد مولكولهای مجاور یك مولكول، با n/V متناسب است. چون هر یك از مولكولهای مجاور، به همین ترتیب، مولكولهای مجاور خود را جذب میكنند، مقدار كل نیروی جاذبه كه مولكولها به هم وارد میكنند با (n/V)**2 متناسب میباشد. معادلهای كه با حتساب حجم كنار گذاشته شده در بالا بدست آوردیم P(V – nb) = nRT بود. فشار را بر حسب سایر پارامترها در معادله بالا بدست میآوریم: P = nRT /(V – nb) اما همانطور كه گفته شد، حضور نیروهای جاذبه باعث كاسته شدن فشار میشود كه درنتیجه یك جمله از مقدار فشار در رابطه بالا كاسته میشود. گفتیم مقدار این فشار كاسته شده با (n/V)**2 متناسب است كه با افزودن ضریب تناسب a مقدار فشار كاسته شده مساوی a(n/V)**2 یا an**2/V**2 میشود. درنتیجه معادله فشار با منظور مقدار كاسته شده به صورت زیر میباشد: P = nRT /(V – nb) – an2/V2 یا شكل معادله واندروالس كه به صورت زیر میباشد: ( P + an2/V2 ) ( V- nb ) = nRT موفقیت این معادله در توجیه رفتار گاز حقیقی، به انتخاب مقادیر a و b درست بستگی دارد. این مقادیر برای هر گاز و در هر دما متفاوت است و باید به درستی از روی دادههای تجربی صحیح محاسبه شوند. البته معادله واندروالس، فقط یكی از چند معادله حالت است كه برای گازهای حقیقی یعنی غیرایدهآل پیشنهاد شده است. دلیل اینكه این معادله بیشتر مورد توجه قرار گرفته است، سادگی نسبی آن و تا حدودی هم موفقیت آن در توصیف رفتار گازهای غیرایدهآل بوده است. بعلاوه شامل ضریبهایی است كه جاذبه و دافعهی بین مولكولها را میتوان توسط آنها توجیه نمود. محاسبه مقادیر a و b از روی دادههای تجربی و از طریق حل معادلاتی صورت میگیرد. روابط برای محاسبه مقادیر a و b در زیر ارائه گردیده است. در صورتی كه به اثبات و راه حل ریاضی آن نیاز دارید، دوباره سؤال بفرمائید. A= 27R**2 T**2/64P B= RT/8P دما و فشار در روابط بالا مربوط به دما و فشار نقطه بحرانی است، یعنی دما و فشار مربوط به نقطه بحرانی در نمودارهای فشار بر حسب حجم . دمای بحرانی، بالاترین دمایی است كه در آن دو فاز گاز – مایع میتوانند تواما" با هم وجود داشته باشند. این نقطه در نقطه عطف افقی ایزوتوزمهای فشار حجم قرار گرفته است.فشار و حجم مولی در این نقطه، به ترتیب فشار بحرانی و حجم بحرانی نامیده میشود. برچسبها: دو شنبه 26 دی 1390برچسب:, :: 11:57 :: نويسنده : پوریا جعفری
برج تقطیر Distillation Tower
برچسبها: دو شنبه 26 دی 1390برچسب:, :: 11:57 :: نويسنده : پوریا جعفری
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
یکی از مهمترین چرخه های بازگشت پذیر، چرخهی کارنو است که توسط سعدی کارنو معرفی شد. این سیستم شامل یک ماده است که انتقال گرما را به عهده دارد و اصطلاحاً " مادهی کار " نامیده میشود. چرخه از دو فرآیند هم دمای بازگشت پذیر (ISOTHERMAL )و دو فرآیند بی در روی بازگشت پذیر (ADIABIATIC ) تشکیل شده است. میتوانید در مدل سازی بالا، مراحل مختلف کار این چرخه را مشاهده کنید. برای سادگی، میتوان مادهی کار را یک گاز ایده آل فرض کرد که در استوانه ای قرار دارد که قاعدهی آن رسانای گرماست، ولی دیواره های آن و پیستون، عایق گرما هستند. نتیجه این چرخه آن است که گرما توسط سیستم به کار تبدیل شده است. اگر چه ماشینهای گرمایی واقعی بر پایهی یک چرخهی بازگشت پذیر کار نمی کنند، ولی چرخهی کارنو ( که بازگشت پذیر است ) اطلاعات مفیدی درباره رفتار هر ماشین گرمایی به دست میدهد و اهمیت خاصی دارد؛ زیرا میتوان اثبات کرد چرخه کارنو تعیین کننده حد بالای بازده ماشینهای حقیقی است و بنابر این هدفی را که باید به آن برسیم مشخص میکند. بازده یک ماشین گرمایی (e) عبارتست از نسبت کار انجام شده توسط ماشین (w) در یک چرخه، به گرمای گرفته شده از منبع گرم (Q1 ):
این معادله نشان میدهد که بازده ماشین گرمایی تا وقتی گرمای خارج شده از سیستم صفر نشود، به یک نمی رسد. تجربه نشان میدهد که ماشین در موقع تخلیهی دود، مقداری گرما از دست میدهد. این، همان مقدار گرمایی است که هدر میرود و در طی فرآیند به کار تبدیل نمی شود. چرخهی کارنو را میتوان با معکوس کردن جهت فرآیندها انجام داد ( توجه کنید که تمامی مراحل این چرخه بازگشت پذیرند. ). در چنین چرخه ای، باید کار روی سیستم انجام شود تا گرما از منبعی با دمای پایین به منبعی با دمای بالا ( یعنی در جهت عکس فرآیندهای خود به خود طبیعت ) منتقل گردد. بنابر این، سیستم مانند یخچال عمل میکند. یعنی با کاری که به آن داده میشود ( توان الکتریکی ورودی ) گرما را از جایی که دمای پایین قرار دارد ( درون یخچال ) به جایی با دمای بالاتر ( اتاق ) منتقل میکند. کارنو نخستین کسی بود که مطالبی علمی در مورد ماشینهای گرمایی منتشر کرد. او در سال 1824 مقاله ای با عنوان " اندیشه هایی دربارهی قدرت محرکهی گرما " منتشر کرد. در آن هنگام استفاده از ماشین بخار که یک ماشین گرمایی است، در صنعت متداول بود. کارنو توجه خود را به این واقعیت معطوف کرد که اختلاف دمای دو منبع، سر چشمهی حقیقی قدرت محرکه است و نوع ماده کار از لحاظ نظری اهمیتی ندارد. او هم چنین این قضیه را - که اهمیت عملی زیادی دارد - بیان کرد: بازده تمام ماشین های بازگشت پذیری که بین دماهای یکسانی کار میکنند، با هم برابر است و بازده هیچ ماشین بازگشت ناپذیری، که بین همان دو دما کار میکند، نمی تواند بیشتر از این باشد. توجه داشته باشید که در این قضیه هیچ اشاره ای به ماده کار نشده است. یعنی بازده یک ماشین بازگشت پذیر مستقل از ماده کار است و تنها به دما بستگی دارد. علاوه بر این، بازده یک ماشین برگشت پذیر، حداکثر مقدار ممکن برای هر ماشینی است که در بین همان دو حدّ دمایی کار میکند. این واقعیت از آن جا ناشی میشود که میتوان نشان داد که در چرخه کارنوQ1/Q2=T1/T2 و در نتیجه: e=1-Q1/Q2=1-T1/T2 برای دست یابی به حداکثر بازده ممکن، دمای T2 باید صفر مطلق باشد. تنها هنگامی که منبع سرد در صفر مطلق (273- درجه سانتی گراد ) قرار گیرد، تمامی گرمای جذب شده از منبع گرم به کار تبدیل خواهد شد. امّا چون نمی توانیم یک منبع سرد با دمای صفر مطلق داشته باشیم، ساختن یک ماشین گرمایی با بازده صد درصد نیز عملاً غیر ممکن است. این تجربه منجر به قانون سوم، ترمودینامیک شده است که میتوان آن را به صورت ساده چنین بیان کرد: با هیچ روشی، هر قدر هم ایده آل باشد، امکان ندارد بتوان دمای یک سیستم را با انجام عملیاتی به تعداد محدود، تا صفر مطلق کاهش داد. در مطالب بعدی در این مورد بیشتر توضیح خواهیم داد. |
برچسبها:
اینم همون جزوهء که قولش رو بهتون داده بودم
مهندسین شیمی از دستش ندید
جزوهء موازنه مواد و انرژی
برچسبها:
برچسبها:
|
|||
<-PollItems->
|
||
|
||||
<-PollItems->
|
||

Create Your Badge ">